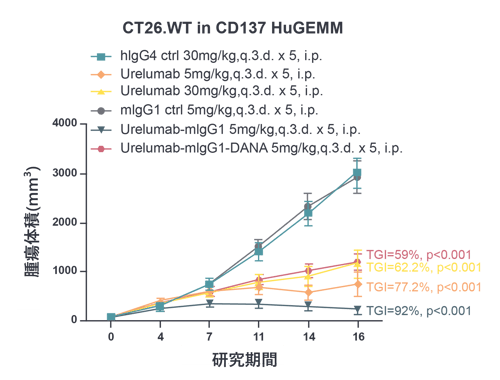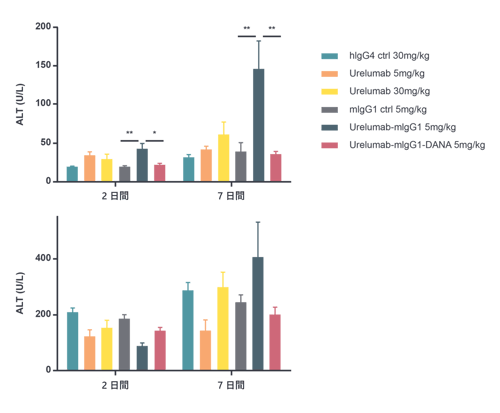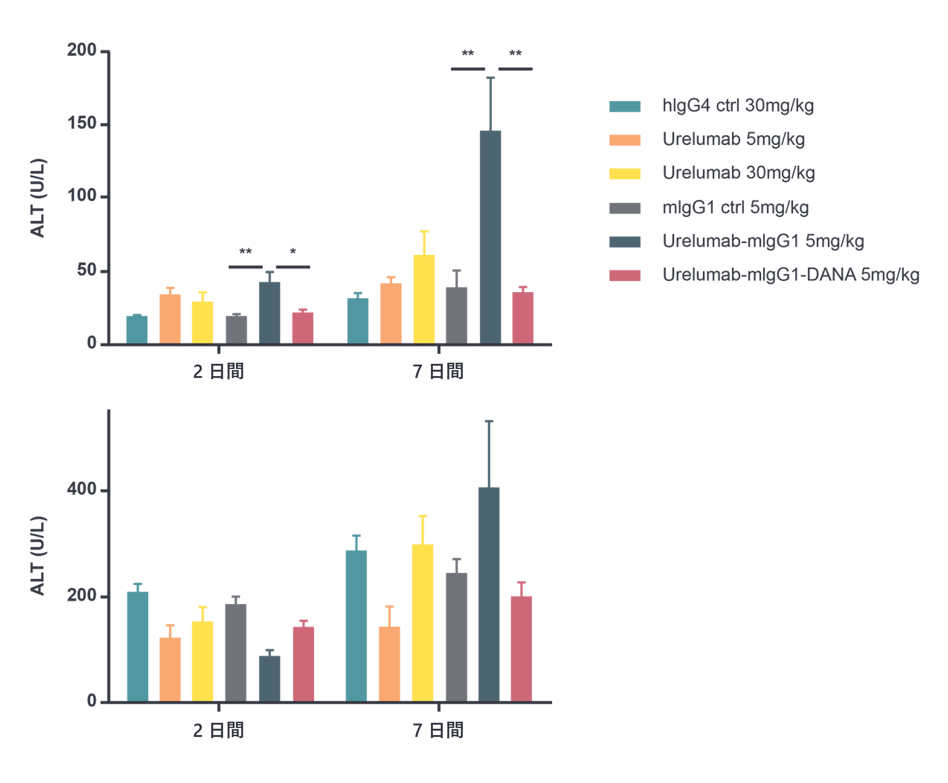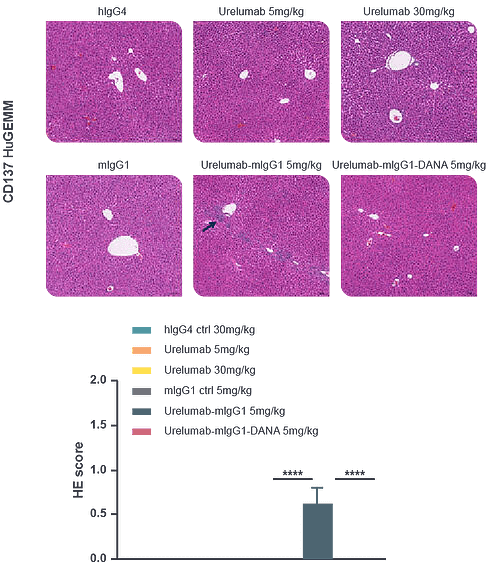
- サービス
- 治療に関する領域
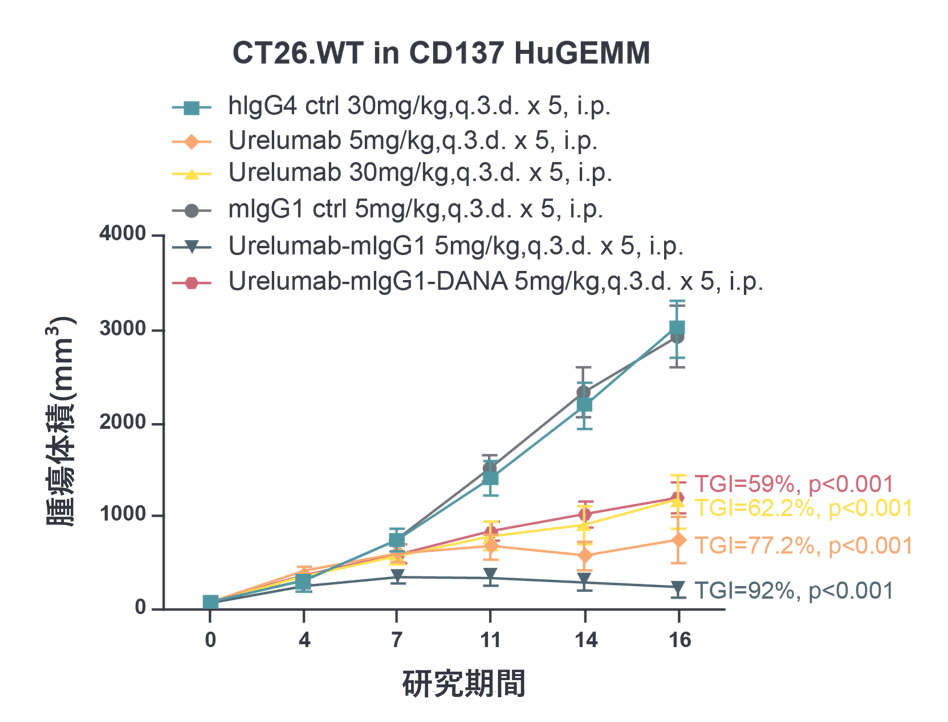
- モデルシステム
- 保有技術
- ゲノミクス
- CrownSyn™ によるサービス
- ディープシーケンシングによる細胞株の認証
- Mouse I/O RNA Seq
- バイオマーカー解析
- 信頼性の高い臨床化学およびバイオマーカーサービス
- サイトカインおよびケモカインプロファイリング
- フローサイトメトリー
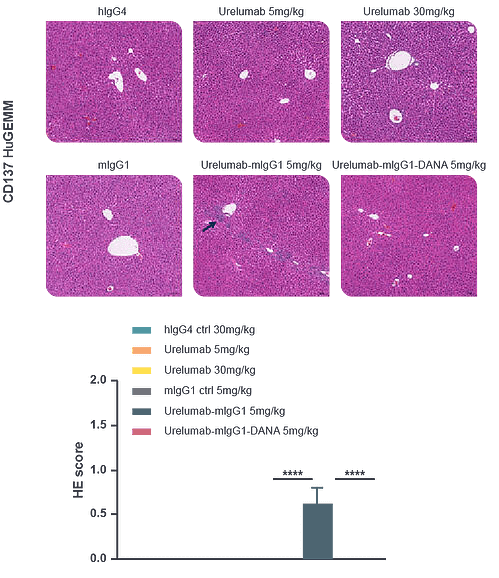
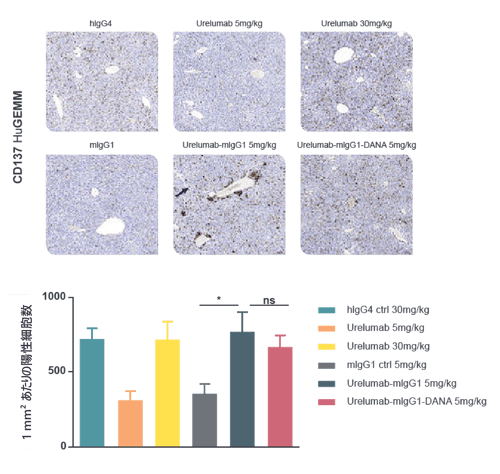
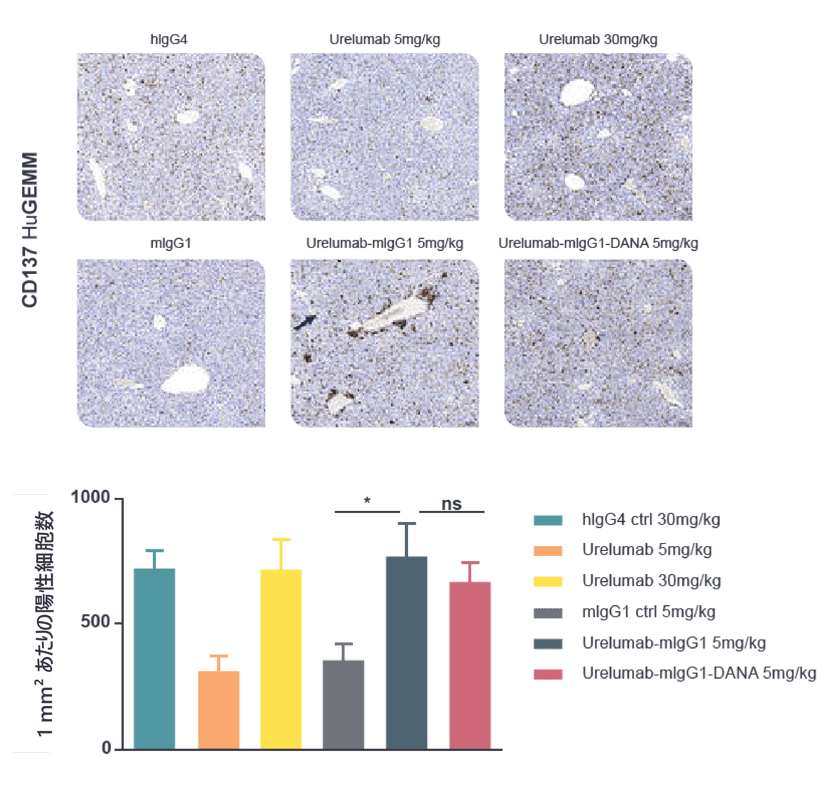
- デジタル病理学
- Tumor Tissue Microarray
- 希少細胞分析
- In Vitro ハイコンテンツイメージング
- HCI
- 3D Ex Vivo患者組織プラットフォーム
- 嚢胞性線維症の 3D 患者由来膨潤アッセイ
- ゲノミクス
- プラットフォームの概要
- 標準ゲノミクスサービス
- 次世代シーケンシングサービス
- 独自のNGSサービス
- ディープシーケンシングによる細胞株の認証
- Mouse I/O RNA-Seq Panel
- NGSデータ解析
- 会社概要
- 会社概要
- 私たちのサイエンス
- Start Your Study Now